电压门控离子通道(VGICs)在电信号传导过程中扮演重要角色。膜电位如何通过电压感受结构域(S1-S4,VSD)调节通道门控(gating),即电压门控机理,是电压门控离子通道的核心问题。在大部分的电压门控离子通道中,超极化膜电位将电压感受结构域稳定在静息状态,通道门保持关闭。膜电位去极化时,电压感受结构域被激活,引起孔道结构域(pore domain)的跨膜螺旋S5-S6的构象变化,通道门打开。为了阐述离子通道的电压门控机制,需要解析激活态和静息态的电压感受结构域的结构。由于在体外条件下难以模拟体内的膜电位环境,捕捉同一个离子通道电压感受结构域分别处于激活态和静息态具有相当大的挑战。
2021年11月23日,澳门·新葡萄新京6663郭江涛团队在PNAS在线发表了题为“Voltage gating and cytosolic Ca2+ activation mechanisms of Arabidopsis two-pore channel AtTPC1”的研究论文,报道拟南芥双孔通道AtTPC1在不同状态下的高分辨率冷冻电镜结构。通过对通道不同状态的结构比较,阐释了AtTPC1的电压门控、细胞内钙离子激活及二者的偶联机制。这项研究为阐明普适性的电压门控机制提供重要的结构信息。
双孔通道(TPCs)属于电压门控离子通道超家族,在植物和动物中广泛表达。TPCs形成同源二聚体,每个亚基包括2个6次跨膜结构域(6-TMI和6-TMII),等价于经典的电压门控离子通道所拥有的4个电压感受结构域和一个孔道结构域。AtTPC1定位于液泡膜上,其通道门开放需要激活态的电压感受结构域II(VSDII)和细胞质基质侧结合钙离子的EF hand结构域。
但另外一方面,液泡腔内的钙离子将电压感受结构域II(VSDII)稳定在静息态,抑制通道开放。这种钙离子的双向调节作用导致很难捕捉处于开放态的AtTPC1的结构。前期研究发现,液泡腔侧的钙离子通过与三个酸性氨基酸Asp240、Asp454和Glu528相互作用来抑制AtTPC1电压感受结构域II。
为了消除液泡腔侧的钙离子的抑制,获得激活态的电压感受结构域II和结合钙离子的EF hand结构域,研究人员构建了这三个位点的突变体AtTPC1ΔCai,并在样品中添加了钙离子。
研究人员解析了钙离子存在条件下的野生型和突变体AtTPC1的冷冻电镜结构。钙离子存在条件下的野生型AtTPC1通道门处于关闭状态,电压感受结构域II处于静息态,EF hand结构域未结合钙离子。钙离子存在条件下的突变体AtTPC1通道门处于半开放状态,电压感受结构域II处于激活态,EF hand结构域结合钙离子(图1)。

图1 AtTPC1野生型及突变体结构。
A,AtTPC1的拓扑结构。B,AtTPC1野生型冷冻电镜密度图。C,AtTPC1野生型单亚基侧视图及EF hand放大图。D,AtTPC1野生型VSDII处于静息态。E,AtTPC1突变体冷冻电镜密度图。F,AtTPC1突变体单亚基侧视图及EF hand放大图。G,AtTPC1突变体VSDII处于激活态。
研究者通过比较野生型和突变体AtTPC1结构揭示了三个机理:
(1)电压门控机理:膜电位去极化驱使VSDII的IIS4螺旋发生垂直平移,带动IIS4-IIS5 linker相对于IIS5的连接处向外旋转,进而使VSDII整体发生旋转。在生理条件下,VSDII的激活会导致IIS6螺旋对方向上的通道打开(图2)。

图2 AtTPC1电压门控机制。
A,AtTPC1电压激活过程中发生IIS4垂直平移以及IIS4-IIS5 linker旋转。B,AtTPC1的VSDII发生旋转。AtTPC1野生型和突变体模型分别用粉色与绿色显示。
(2)细胞内钙离子激活AtTPC1的分子机理:膜电位去极化驱使VSDII的旋转,VSDII进而通过L1-2拉动EF hand进行平移与旋转,使得SU与SN两个螺旋从EF hand上解离,暴露出EF hand 2和S0上的钙离子结合位点。钙离子的结合,增强了EF hand内部及其与IS1的紧密堆积,使得E1发生移动,带动与其形成一根螺旋的IS6向外旋转,导致IS6螺旋对方向上的通道打开(图3)。
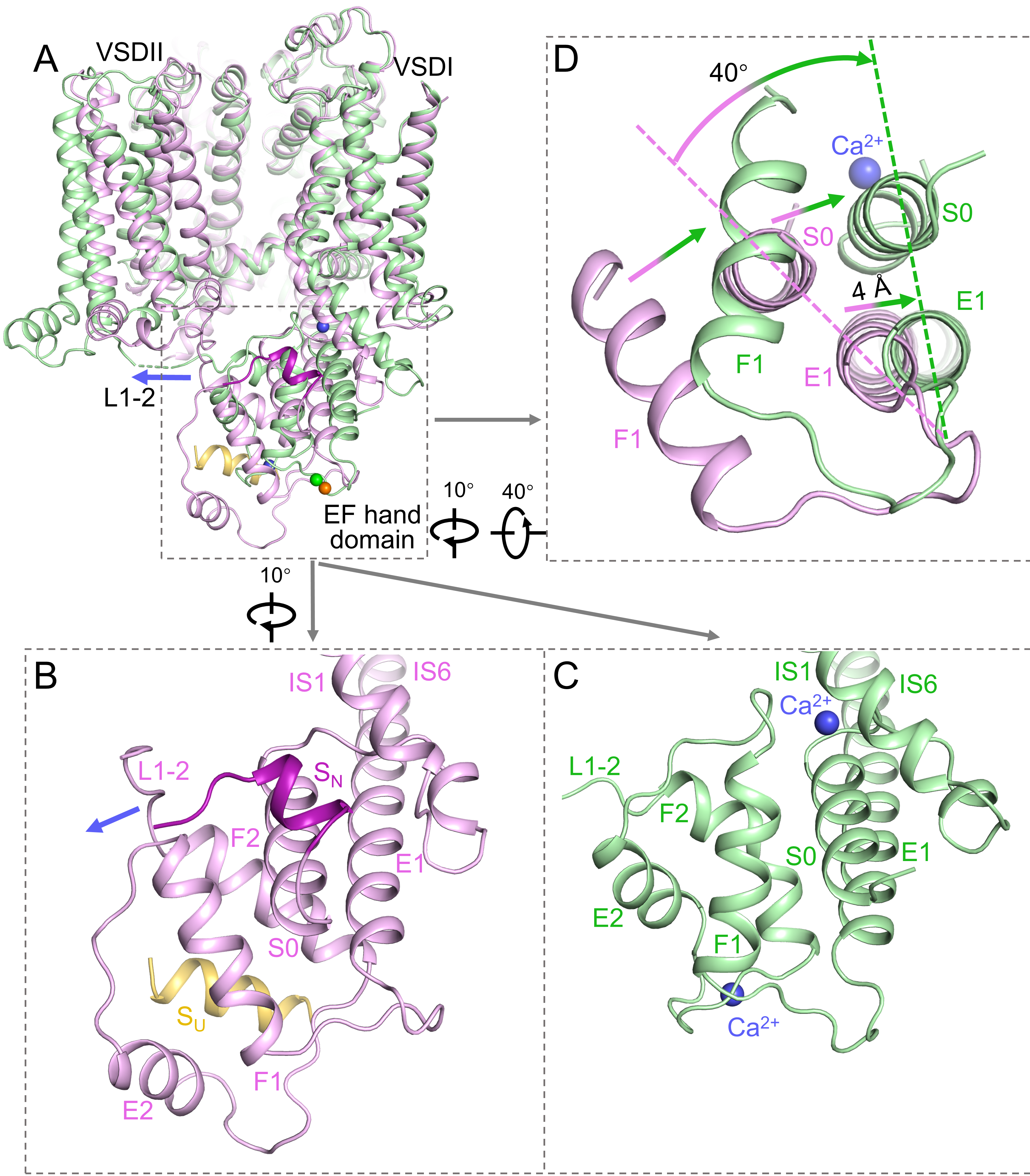
图3 细胞内钙离子激活AtTPC1的分子机理。
A,AtTPC1野生型(粉色)与突变体(绿色)叠加侧视图。(B,C,D)图A放大显示。
(3)电压门控和细胞内钙离子激活的偶联机制:研究者发现,在VSDII抑制的情况下,高浓度(50 mM)钙离子也无法激活EF hand;但是一旦VSDII被激活,低浓度(1 mM)钙离子就可以激活EF hand。因此膜电位去极化激活VSDII与钙离子激活EF hand是偶联的,并由L1-2,SU和SN介导(图4)。

图4 电压门控和细胞内钙离子激活的偶联机制。
综上所述,本研究通过突变液泡腔侧的钙离子抑制位点和改变蛋白样品中的钙离子浓度,捕捉关闭和部分开放状态的AtTPC1。通过比较两种不同的构象,解释了AtTPC1的电压门控、钙离子激活以及二者的偶联机制。
澳门·新葡萄新京6663医学院生物物理学系硕士研究生叶繁、博士后徐令怡、博士研究生李潇潇为该论文共同第一作者;澳门·新葡萄新京6663生物物理系郭江涛研究员、美国德克萨斯大学西南医学中心姜有星教授为该论文的共同通讯作者。本研究得到了澳门·新葡萄新京6663医学院杨巍教授的支持。本研究受科技部、国家自然科学基金、浙江省自然科学基金、中央高校基本科研专项资金的资助。












