随着社会经济的发展,肥胖和2型糖尿病(T2D)的发病率日益升高,严重危害人类健康。越来越多的研究表明,肥胖和T2D是一种慢性代谢炎症(Meta-inflammation)性疾病。以往的许多研究提示,脂肪组织中的巨噬细胞(Adipose tissue macrophages, ATMs)具有重要的生理和病理功能:在正常生理情况下,ATMs有助于维持脂肪组织的稳态及功能;而长期营养过剩和内环境稳态失调则会导致ATMs发生炎症极化和过度激活,是造成脂肪组织炎症、胰岛素抵抗和代谢失衡的重要原因。然而,在肥胖和T2D发病过程中,ATMs如何感受机体内环境的变化、引起异常活化和代谢炎症的分子机制有待阐明。
T2D是由遗传和环境因素共同作用引起的。近年来,越来越多的研究提示表观遗传学机制,能够整合环境因素的变化影响基因表达和信号转导,在T2D的发病过程中发挥重要作用。表观遗传学机制主要包括三个方面:DNA甲基化、组蛋白修饰和染色质重塑。染色质重塑由染色质重塑复合体(Chromatin remodeling complex, CRC)完成。SWI/SNF是由多个亚基组成的复合体,是CRC家族的重要成员。BAF60s作为SWI/SNF复合体的核心亚基(包含a、b 和c)能够与组织特异性转录因子结合,招募SWI/SNF到靶基因周围,通过染色质重塑影响靶基因的表达和下游生物学功能。
孟卓贤课题组长期专注研究BAF60s介导的染色质重塑在细胞营养感受、代谢调控以及肥胖和T2D发病过程中作用和机制。课题组过去研究发现BAF60a在肝脏和脂肪组织中高表达,在肝脏脂质感受、胆固醇代谢和脂肪组织产热功能的调控中发挥重要作用。而BAF60c在骨骼肌特别是糖酵解功能旺盛的白肌中高表达,在骨骼肌葡萄糖感受、摄取利用和全身血糖稳态调控中发挥关键作用。但是迄今为止,BAF60s介导的染色质重塑在巨噬细胞活化、及其相关的代谢炎症和全身糖脂代谢稳态调控中的作用和机制尚不清楚。
2022年7月13日,澳门·新葡萄新京6663/附属第二医院孟卓贤研究员团队和医学院附属杭州市第一人民医院老年病科高越教授团队合作在Diabetes杂志在线发表 “BAF60a Deficiency in Macrophage Promotes Diet-Induced Obesity and Metabolic Inflammation” 的研究论文。

该研究发现,在野生型小鼠附睾白色脂肪组织(Epididymal white adipose tissue, eWAT)和腹股沟白色脂肪组织(Inguinal white adipose tissue, iWAT)及其血管基质成分(Stromal vascular fractions, SVF)中,BAF60a和BAF0b的表达量较高,而BAF60c几乎不表达;进而,作者发现2型糖尿病模型(db/db)小鼠的eWAT-SVF和iWAT-SVF中BAF60a的表达量下调,而BAF60b的变化并不显著。巨噬细胞是脂肪组织SVF中的主要细胞类型之一。已知T2D个体血液循环中LPS、脂肪酸和炎症因子的水平均显著升高。有意思的是,作者发现上述处理均能显著下调巨噬细胞中BAF60a的表达,提示BAF60a在T2D的ATM炎症活化和胰岛素抵抗中发挥重要作用。为此,作者构建了髓系细胞特异性BAF60a 敲除(BaMKO)小鼠模型,发现BaMKO显著加重了HFD诱导的肥胖、脂肪肝、胰岛素抵抗和糖耐量受损,伴随着白色脂肪组织中大量巨噬细胞浸润,形成典型的皇冠样结构(Crown-like structures,CLS)。
为了进一步研究BAF60a在ATM炎症活化过程中的功能,作者对HFD小鼠白色脂肪组织的SVF进行了流式细胞术分析,发现BaMKO显著增加了小鼠脂肪组织中CD11c+ M1型巨噬细胞的比例。研究人员进一步对分选出的iWAT-SVF F4/80+ ATMs和eWAT-SVF F4/80+ ATMs进行RNA-Seq测序,发现BAF60a通过转录重编程影响趋化因子和炎症基因的表达,调控ATM在脂肪组织中的招募和炎症活化。进而,作者利用ATAC-Seq技术分析了BAF60a敲除对白色脂肪组织中F4/80+ATMs染色质可及性的影响,结果显示BAF60a敲除显著改变了ATM的染色质景观(Chromatin landscape),进而特异性调控ATM招募和活化相关基因的转录。BAF60a作为染色质重塑因子,需要与特定转录因子结合才能实现对下游靶基因的选择性调控。为了进一步确定ATM中与BAF60a直接互作的转录因子,作者对野生型小鼠的ATMs进行了BAF60a的 CUT&Tag-Seq实验,在全基因组水平解析BAF60a的结合位点。进而,作者通过将ATAC-Seq中得到的BAF60a敲除引起显著变化的DNA序列 (Differential accessible peaks, DAP) 与BAF60a CUT&Tag-Seq 的DNA序列进行重叠和基序分析(motif analysis),发现并通过多种实验方法验证转录因子Atf3能够BAF60a直接结合,通过染色质重塑(chromatin remodeling)介导转录重编程,调控巨噬细胞中多个趋化因子和炎症基因的表达,从而在ATM招募、炎症活化、脂肪组织代谢炎症和胰岛素抵抗中发挥重要作用。
此外,作者还构建了髓系细胞特异性BAF60a过表达(BaMKI)小鼠模型,发现激活BAF60a通路能够显著抑制HFD诱导的白色脂肪组织中ATM的招募和炎症活化。而髓系细胞特异性BAF60b(BbMKO)、BAF60c(BcMKO)敲除小鼠在正常饮食和HFD喂养条件下均未现出明显的代谢异常。
本论文以临床问题为导向,聚焦肥胖和2型糖尿病脂肪组织中ATM炎症活化的机制,借助髓系细胞BAF60a特异性敲除和过表达小鼠模型,利用RNA-Seq,ATAC-Seq,CUT&Tag-Seq等多种转录组、表观组和基因组分析技术,揭示BAF60a能够整合肥胖和T2D相关的内毒素血症、脂毒性和炎症等机体微环境的变化,与转录因子Atf3互作,通过染色质重塑介导的表观遗传学机制调控白色脂肪组织中ATM炎症活化和胰岛素抵抗,本研究有助于进一步阐明肥胖及T2D相关代谢炎症的分子机制,为这些疾病的临床诊治提供了新的思路和靶点(图1)。
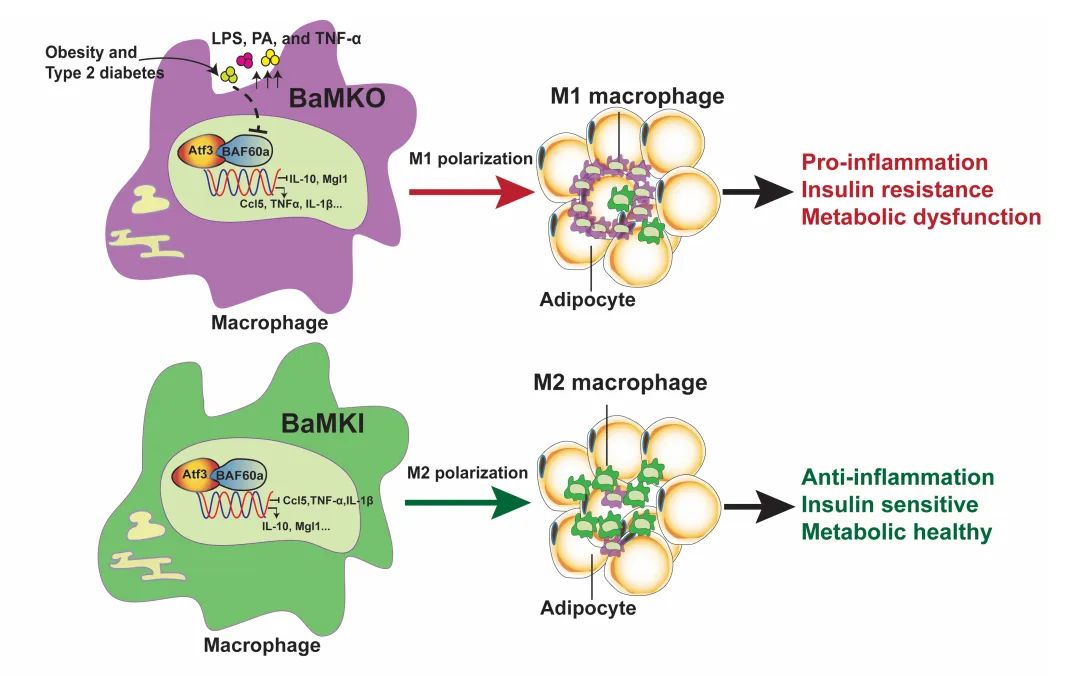
图1 BAF60a通过与Atf3相互作用调控ATMs极化和脂肪组织炎症
澳门·新葡萄新京6663/附属第二医院孟卓贤研究员为论文最后通讯作者,杭州市第一人民医院老年病科高越教授为论文的共同通讯作者,澳门·新葡萄新京6663孔勤博士后,杭州市第一人民医院老年病科邹佳欢医师为论文共同第一作者。本课题还得到澳门·新葡萄新京6663王迪教授、Dante Neculai教授,和复旦大学徐延勇教授的大力支持。本研究受到科技部重大研发计划、国家自然科学基金、浙江省自然科学基金、澳门·新葡萄新京6663原创探索项目和杭州市医学重点学科的资助,并得到了浙江省疾病蛋白质组学重点实验室、澳门·新葡萄新京6663医学院公共技术平台和实验动物中心的支持。
原文链接:https://doi.org/10.2337/db22-0114












