在心脏中,KCNQ1与辅助亚基KCNE1形成慢延迟整流型电流,它对于心脏动作电位的复极化非常重要。KCNQ1的功能缺失突变会诱导长QT综合征1(LQT1),导致危及生命的心律失常。LQT1是长QT综合征的一个常见的亚型,约占临床案例的30-35%。临床研究已经确定了数百种可导致LQT1的KCNQ1变体,因此KCNQ1通道对维持心律方面至关重要,并且已被证实是抗心律失常的潜在治疗靶点。
2022年11月4日,澳门·新葡萄新京6663郭江涛课题组、澳门科技大学侯盼盼课题组和澳门·新葡萄新京6663杨巍课题组在《PNAS》上合作发表了题为“Structural mechanisms for the activation of human cardiac KCNQ1 channel by electro-mechanical coupling enhancers”的研究论文,报道了人源KCNQ1-CaM复合物在apo状态、激动剂ML277结合状态、以及ML277和PIP2同时结合状态的4个高分辨率冷冻电镜结构,揭示了配体激活KCNQ1通道的分子机制。

在结合ML277的KCNQ1-CaM结构(KCNQ1-CaMML277)中,ML277结合在S4-S5 linker、S5以及相邻亚基的S5和S6形成的疏水口袋中。对比apo状态的结构可以发现,ML277直接引起S4-S5 linker的向上移动和S6的向外旋转和移动,导致通道开放(图1A-E)。与之前报道的KCNQ1的开放态的结构不同,ML277激活KCNQ1并不影响C端结构域(CTD)的构象。
在激动剂ML277和膜脂分子PIP2同时结合的条件下,研究人员捕获到了两种不同的开放态的KCNQ1-CaM的结构(KCNQ1-CaMML277-PIP2-A和KCNQ1-CaMML277-PIP2-B)。其中KCNQ1-CaMML277-PIP2-A与单独结合ML277的结构类似,而KCNQ1-CaMML277-PIP2-B的C端结构域和CaM发生了较大的结构重排(图1F)。比较这两个结构,研究人员推测,在电压感受结构域VSD被激活时,结合在VSD和孔道结构域PD之间的PIP2发生扰动,破坏了VSD和CaM的互作,导致KCNQ1的CTD和CaM发生结构重排,形成更为稳定的构象,从而激活通道(图1G-H)。
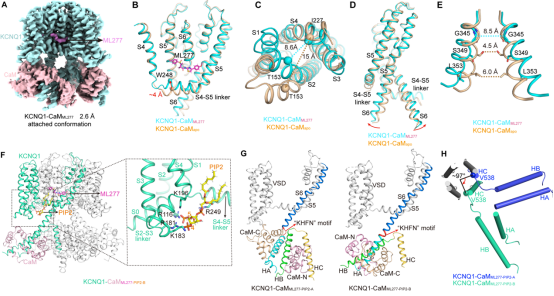
图1. 电压门控钾离子通道KCNQ1-CaM的结构
A. KCNQ1-CaMML277的密度图
B. ML277诱导S4-S5 linker向上移动
C. KCNQ1-CaMapo和KCNQ1-CaMML277中VSD的结构差异的俯视图
D. KCNQ1-CaMapo和KCNQ1-CaMML277中PD的结构差异的侧视图
E. KCNQ1-CaMapo和KCNQ1-CaMML277中阀门的结构差异的侧视图
F. KCNQ1-CaMML277-PIP2-B的整体结构和PIP2结合位点的放大视图
G. KCNQ1-CaMML277-PIP2-A和KCNQ1-CaMML277-PIP2-B中CTD和CaM的不同结构排列
H. KCNQ1-CaMML277-PIP2-A和KCNQ1-CaMML277-PIP2-B中HA、HB和HC螺旋的结构比较
本研究解析了人源KCNQ1-CaM通道在apo以及ML277和PIP2结合状态下的高分辨率结构,揭示了ML277和PIP2激活KCNQ1通道的分子机制,并为开发抗心律失常的新疗法开辟了新路径。
澳门·新葡萄新京6663博士生马德敏和澳门科技大学钟玲为论文的共同第一作者。澳门·新葡萄新京6663郭江涛、澳门科技大学侯盼盼和澳门·新葡萄新京6663杨巍为共同通讯作者。本研究的电镜数据收集得到澳门·新葡萄新京6663冷冻电镜中心的大力支持。本研究受科技部、国家自然科学基金、浙江省自然科学基金、中央高校基本科研专项资金的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2207067119












