作为细胞内重要的物质降解途径,自噬发现在维持细胞稳态过程中起关键作用,其功能的异常往往与人类许多重大疾病的发生发展如神经退行性疾病、代谢性疾病等密切相关。细胞自噬研究的兴起源于日本科学家大隅良典教授,其在90年代利用酿酒酵母作为模式生物,通过一系列的遗传学和分子生物学手段,解析了氮源饥饿情况下自噬发生的分子机器以及生理功能。经过30年的发展,我们对于自噬发生的分子机制和生理病理意义的认识有了长足发展。
物质代谢和能量代谢是生命活动的两个基本特征。细胞自噬同样受到物质和能量代谢的调控并反过来参与物质和能量代谢的调控。目前物质代谢调控细胞自噬的分子机制相对研究得清楚一些。氨基酸饥饿、氮源饥饿、生长因子缺乏及雷帕霉素处理等均能诱导细胞自噬的发生,一系列信号分子和降解底物也被陆续鉴定出来。然而,我们对于能量代谢与细胞自噬的关系,大部分仍然停留在能量感受器AMPK通过磷酸化某个底物蛋白(如ULK1)调控能量匮乏诱导的自噬这一层面,对于新的信号通路、参与能量匮乏诱导自噬的基因异质性、特异性降解底物和生理意义(如能量消耗多的器官如心脏、肌肉,尤其对能量供给不足反应最为敏感的大脑神经细胞)尚知之甚少。
我们以前的研究发现,在葡萄糖饥饿(造成能量匮乏)情况下,细胞的ROS水平有显著地升高,使得原先定位于细胞核的DNA损伤感受器Mec1蛋白(哺乳动物为ATR)从细胞核中出来并以puncta的形式招募到线粒体上用于维持线粒体的有氧呼吸,并发现线粒体的有氧呼吸活性对于能量匮乏诱导的自噬为必需;同时在线粒体上,能量感受器Snf1(哺乳动物为AMPK)通过磷酸化Mec1参与线粒体有氧呼吸活性的维持。最后,磷酸化的Mec1通过影响自噬Atg1复合体的形成来参与能量匮乏诱导的自噬。然而,我们对于Mec1在能量匮乏情况下如何参与其自噬的发生并不清楚。
2022年12月28日,澳门·新葡萄新京6663易聪课题组在美国科学院院刊《PNAS》上在线发表题为“Mec1 regulates PAS recruitment of Atg13 via direct binding with Atg13 during glucose starvation-induced autophagy”的研究论文,发现了DNA损伤感受器Mec1调控能量匮乏诱导自噬的分子机制。

在此项研究中,研究人员通过高分辨率显微镜观察到Mec1 puncta与自噬的前体结构PAS(phagophore assembly site)存在着一定比例的共定位。随后的生化分析也证实了这点。由于Mec1 puncta在葡萄糖饥饿情况下也招募到线粒体上,我们为此猜想Mec1 puncta可能作为一个linker将处于葡萄糖饥饿情况下的线粒体和自噬体连接起来。为了证实这一猜想,我们分别对线粒体、Mec1和自噬体通过三种不同的荧光进行标记,发现Mec1 puncta的确处于线粒体和自噬体互作的contact sites上,当对Mec1进行敲低时,我们发现线粒体和自噬体之间的距离有明显的增大。随后的生化分析也证实了这种现象的真实性。
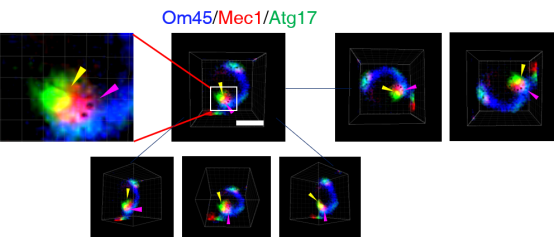
图1 Mec1 puncta位于线粒体和自噬体互作的contact sites上。Om45为线粒体marker,Atg17为自噬体marker。
以前我们的研究发现Mec1 puncta通过线粒体上的Ggc1蛋白招募到线粒体上,那么,Mec1 puncta通过与自噬体的哪个蛋白结合来介导Mec1 puncta与自噬体的结合?我们通过一系列的酵母双杂交、体外pulldown和免疫共沉淀实验证实了自噬前体蛋白Atg13与Mec1存在着直接互作。通过鉴定Mec1-Atg13互作的结合区域,我们发现 Atg13蛋白上存在一个Mec1-结合区域(Mec1-Binding Region (MBR)),Mec1蛋白上存在一个Atg13-结合区域(Atg13-Binding Region (ABR)),这两个区域介导了Mec1-Atg13的互作。如果对它们结合的这个区域进行缺失或者突变,则发现在葡萄糖饥饿情况下, Mec1 和Atg13招募到自噬前体都会受到极大地抑制,进而抑制了葡萄糖饥饿诱导的自噬。有意思的是,我们发现DNA损伤诱导的自噬也通过Mec1-Atg13互作这条通路来启动。

图2 细胞感知葡萄糖饥饿并启动自噬的模式图
综上所述, 我们发现了Mec1 puncta位于线粒体和自噬体互作的contact sites上,并调控了葡萄糖饥饿情况下线粒体和自噬体的互作;Mec1通过与Atg13互作促进了Atg13和Mec1招募到自噬前体上,进而启动能量匮乏诱导的自噬和DNA损伤诱导的自噬。
澳门·新葡萄新京6663易聪为本文通讯作者,其课题组成员姚伟静,李宜醒(已毕业),陈颖聪和陈禹亭为本文的共同第一作者。医学院博士后赵鹏伟、课题组成员张毅,江强、临床专业本科生(现协和研究生)冯雨瑶为本课题的完成做出了重要贡献。该课题的开展还得到生化系刘伟教授,孙启明教授,周以?K教授,澳门·新葡萄新京6663徐鹏飞教授,杨帆教授,医学院附属第二医院钟会明医生,湖州师范学院吴酬飞教授、张立钦教授的大力支持。此研究得到了国家基金委、科技部、浙江省自然科学基金委杰出青年基金等经费资助。












