病毒感染因其所致传染性疾病多种多样,同时伴随着较高的发病率和死亡率,因此极大地威胁着人类的健康和生命。
I型干扰素(IFN-I)信号是机体抗病毒天然免疫应答的核心。病毒感染发生时,模式识别受体(PRRs)通过检测识别病毒核酸和蛋白成分,迅速启动下游抗病毒免疫反应,激活IFN-I信号并诱导干扰素刺激基因(ISGs)表达,发挥抗病毒效应,保护机体抵抗病毒入侵。抗病毒免疫应答受到机体的精准调控,但IFN-I信号通路如何调节抗病毒天然免疫应答,目前很大程度上依然未知。
2023年1月21日,澳门·新葡萄新京6663免疫学研究所蔡志坚/王建莉课题组在《Cell Reports》在线发表题为Type I interferon/STAT1 signaling regulates UBE2M-mediated antiviral innate immunity in a negative feedback manner的文章。阐明了巨噬细胞的UBE2M在激活机体抗病毒感染过程中的重要作用,揭示了一条IFN信号通过抑制UBE2M水平,负反馈调节抗病毒免疫应答的新机制,并开发了一款以牛奶来源的胞外囊泡为递送载体,通过口服便可提高机体抗病毒免疫的新制剂。

作为胞浆中最重要的RNA病毒感受器,RIG-I在抗RNA病毒天然免疫应答过程中发挥着至关重要的作用。因此,阐明细胞内RIG-I信号通路的调控机制具有重要意义。本研究前期通过分析细胞中RIG-I的互作蛋白,筛选出UBE2M分子可能作为RIG-I潜在的调控蛋白。
通过一系列体内、外实验,课题组发现,巨噬细胞的UBE2M可以正向调节RIG-I介导的IFN-I信号。UBE2M通过直接结合RIG-I,抑制RIG-I与其E3泛素连接酶STUB1之间的互作,从而抑制RIG-I的蛋白酶体降解,增加胞内的RIG-I蛋白水平,从而促进巨噬细胞分泌IFN-I。同时,RNA病毒感染以IFN/STAT1信号依赖的方式抑制巨噬细胞UBE2M的表达。病毒感染通过激活的STAT1信号直接促进E3连接酶Trim21的转录,而TRIM21作为UBE2M的E3泛素连接酶介导UBE2M降解,进而抑制了由UBE2M介导的IFN-I的产生,形成一个负反馈调节环路。为实现该研究发现的转化应用,作者将缺乏E3连接酶活性的TRIM21(TRIM21-ΔRING)装载于牛奶来源的胞外囊泡(mEVs)上。口服这些mEVs可有效将TRIM21-ΔRING递送至肺脏和肝脏巨噬细胞,TRIM21-ΔRING通过与TRIM21竞争性结合UBE2M,显著抑制TRIM21介导的UBE2M蛋白降解,从而增强了机体的抗病毒免疫并加速了病毒的清除。
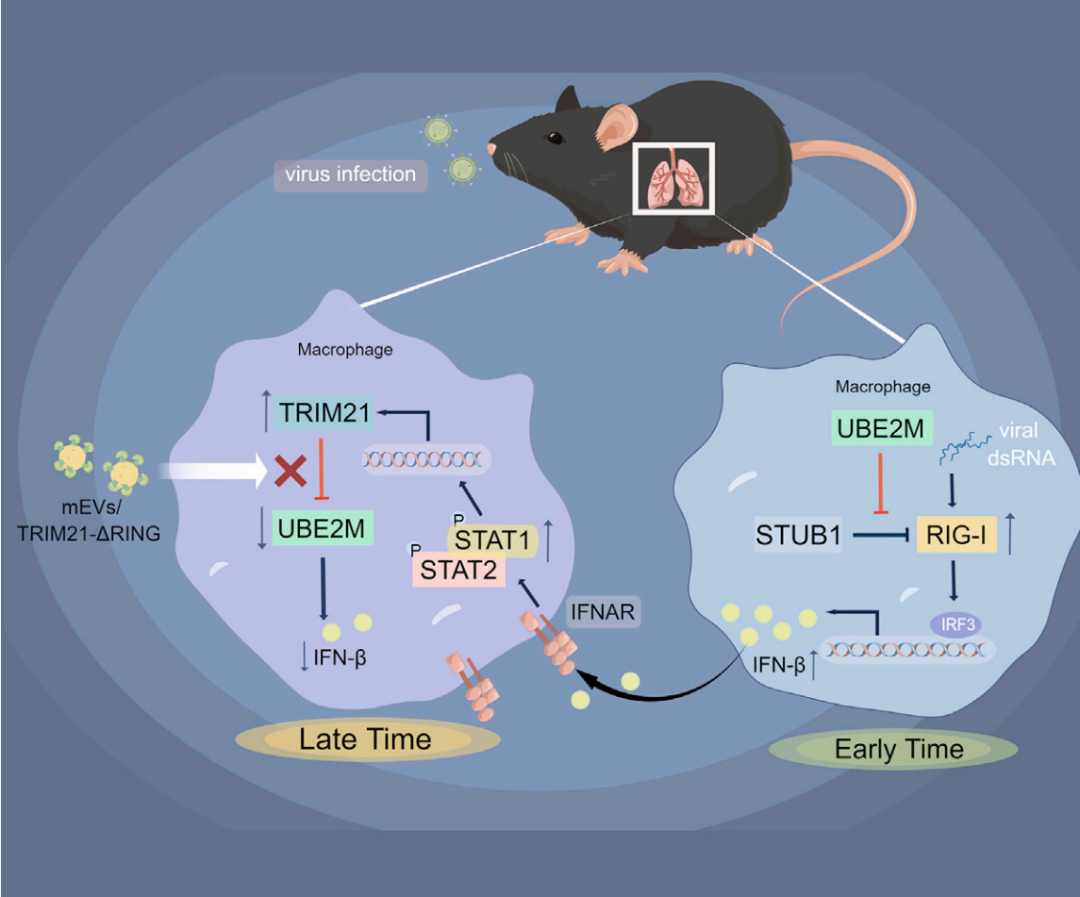
综上所述,本研究表明巨噬细胞UBE2M在抗RNA病毒天然免疫应答的调节过程中发挥了不可忽视的作用,揭示了一条IFN-I信号通过调控UBE2M表达,负反馈调节抗病毒免疫的新机制,并概念验证了装载mEVs的TRIM21-ΔRING是有效的抗病毒制剂,其与牛奶相同的口服方式提示该制剂的安全性,具备较高的转化前景。
澳门·新葡萄新京6663蔡志坚教授、澳门·新葡萄新京6663附属第二医院重症医学科张根生教授、澳门·新葡萄新京6663王建莉教授和卢信良博士后为论文的共同通讯作者。澳门·新葡萄新京6663博士研究生孔祥辉、博士后卢信良和博士研究生王识博为论文的共同第一作者。
原文链接:
http://doi.org/10.1016/j.celrep.2023.112002












