炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),是一组慢性复发性炎症性疾病,严重危害患者的胃肠道健康。作为IBD的重要标志之一,肠道上皮细胞(IECs)异常死亡引起肠道屏障受损,肠道微生物侵入固有层激活炎症反应,进而导致更多的IECs死亡。有研究表明,靶向IECs的治疗可以有效缓解炎症性肠病,然而其调控机制仍尚待研究。
2023年2月 16 日,澳门·新葡萄新京6663/邵逸夫医院柯越海教授、张雪副教授课题组联合邵逸夫医院姜支农课题组在《JCI Insight》杂志在线发表研究论文“Epithelial Gab1 calibrates RIPK3-dependent necroptosis to prevent intestinal inflammation”。该研究揭示了靶向肠道上皮细胞的IBD治疗的新靶点,在肠道上皮细胞中,支架蛋白Gab1通过影响受体相互作用蛋白激酶RIPK1/RIPK3复合物的形成,抑制肠道上皮细胞中的坏死性凋亡信号,并进一步延缓IBD进程,确定了Gab1在肠道炎症及炎症相关结直肠癌中的保护作用。

本研究通过临床数据分析发现,相较于健康人群,IBD患者肠黏膜Gab1表达量显著下降,且与疾病严重程度呈负相关。经anti-TNF抗体治疗有效的UC患者,其粘膜Gab1水平显著上升。单细胞RNA测序数据分析显示,Gab1的差异表达主要定位于结肠上皮细胞。小鼠肠组织Bulk-RNA测序差异表达基因分析富集表明,结肠炎微环境中Gab1敲除与细胞程序性死亡、炎症反应、细胞因子分泌等过程有关。
IBD疾病进程中,肠道上皮细胞经历多种细胞程序性死亡方式。本研究明确了在肠炎微环境中,Gab1敲除导致下游RIPK1/RIPK3/MLKL信号轴过度活化,进而引起IECs发生异常坏死性凋亡。质谱数据进一步表明该过程中Gab1与极光激酶A(AURKA)结合,从而抑制坏死性凋亡复合物RIPK1/RIPK3的组装,最终限制肠道上皮细胞坏死性凋亡并保护肠屏障完整性。
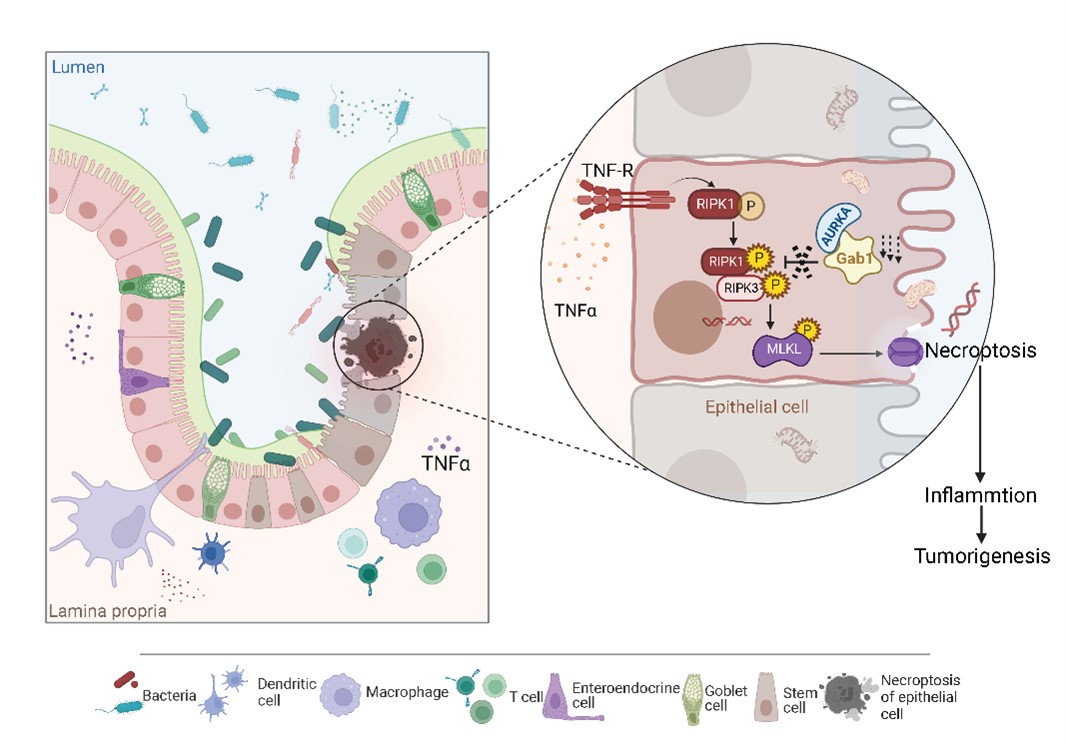
支架蛋白Gab1调控炎症环境肠上皮细胞坏死性凋亡的分子机制模式图
上述研究表明,Gab1是维持上皮屏障完整性的关键保护分子,通过限制过度的坏死性凋亡来抵抗肠道炎症。这些发现有助于深入理解IBD发病机制,也为IBD临床anti-TNF单抗治疗与anti-RIPK1小分子抑制剂治疗联合治疗提供新思路及理论依据。
澳门·新葡萄新京6663张雪副教授、医学院附属邵逸夫医院姜支农教授为本文通讯作者,医学院附属邵逸夫医院胥佳琦博士、八年制博士研究生李世豪和金威博士为论文共同第一作者。感谢澳门·新葡萄新京6663林文龙副教授对本研究的支持,该研究得到国家自然科学基金资助。
原文链接:https://insight.jci.org/articles/view/162701












