肝脏是胃癌转移的主要器官,然而,胃癌肝脏转移的机制至今仍知之甚少,其临床治疗的方案十分有限。因此,我们迫切需要系统筛查和鉴定胃癌肝转移相关基因,探究胃癌肝转移的分子机理和发现新的治疗靶点。
2023年2月17日,澳门·新葡萄新京6663周天华/卓巍教授课题组在Experimental & Molecular Medicine杂志上在线发表了题为“MAPK4 silencing in gastric cancer drives liver metastasis by positive feedback between cancer cells and macrophages”的研究论文。通过人胃癌原位自发肝转移小鼠模型,首次揭示了MAPK4可能是胃癌肝转移过程的关键调控分子,MAPK4下调介导的肿瘤细胞和巨噬细胞之间的正反馈环路是胃癌转移治疗的潜在靶点。

研究人员首先通过胃癌的原位小鼠模型对肝转移相关基因进行了系统的筛选。通过三轮体内筛选分离出了具有高的肝转移能力的子代细胞系,进一步通过转录组分析发现丝裂原活化蛋白激酶4(MAPK4)是在肝转移能力强的细胞中下调最明显的基因,并且MAPK4的敲低能够显著促进胃癌细胞的肝脏转移。临床相关性分析发现,MAPK4在胃癌组织相对于癌旁组织下调表达,并且MAPK4的下调与胃癌病人较差的预后相关。
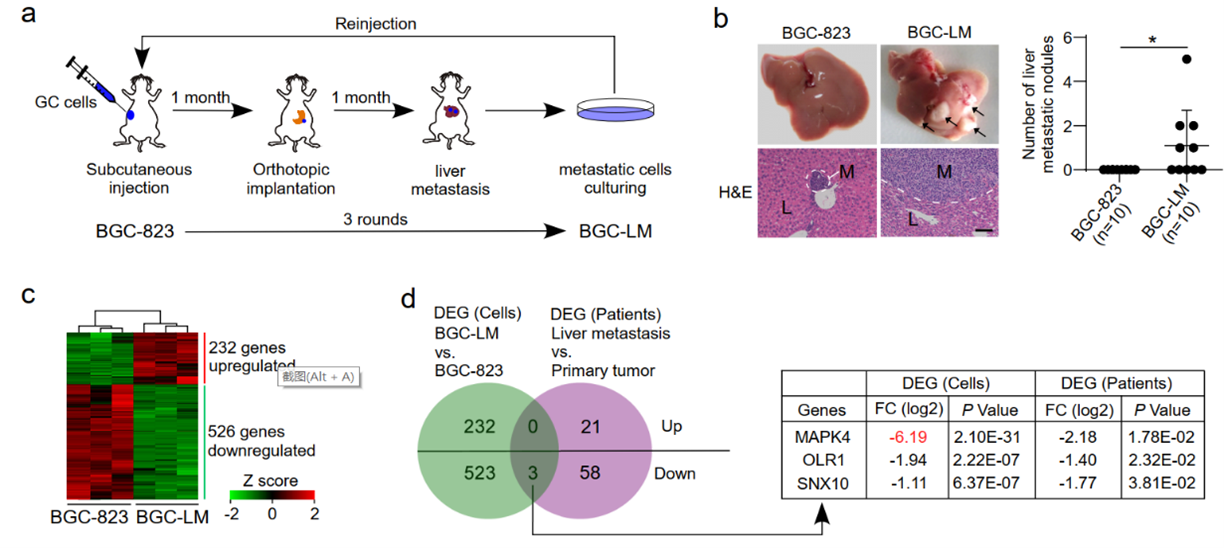
有趣的是,在研究过程中发现MAPK4的敲低在体外抑制胃癌细胞的侵袭能力,但是在动物体内却促进胃癌细胞的侵袭,这一现象提示MAPK4调控胃癌转移的功能可能依赖于肿瘤微环境。
研究人员通过实验发现,原位肿瘤中MAPK4能影响肿瘤细胞的分泌谱,其中,低表达的MAPK4上调了巨噬细胞迁移抑制因子(MIF)的分泌,MIF通过激活M2型肿瘤相关巨噬细胞极化,从而促进了胃癌细胞的肝转移。进一步的机制研究表明,MAPK4能够与MIF相互作用并磷酸化MIF,进而促进MIF的泛素化降解。
反过来,研究人员还发现,M2型肿瘤相关巨噬细胞能通过促进肿瘤细胞的上皮-间质转化EMT,进一步抑制肿瘤细胞中MAPK4的表达。首次揭示了在肿瘤微环境中,MAPK4下调介导的胃癌细胞和巨噬细胞之间的一个新的正反馈调节环路,驱动胃癌细胞的肝脏转移。
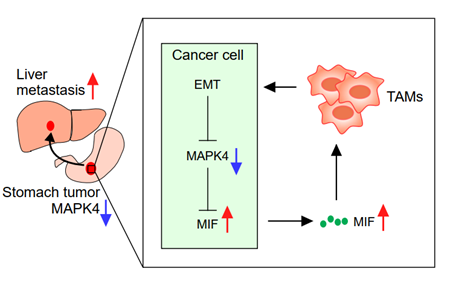
综上所述,本研究通过构建小鼠原位自发肝转移模型,系统性的筛选了胃癌肝转移关键调控基因,发现MAPK4可能是胃癌肝转移的关键抑制基因,并阐述了MAPK4通过影响胃癌细胞的分泌谱,调控微环境巨噬细胞的极化,促进胃癌肝转移的分子机制,为胃癌肝转移的治疗提供了潜在的靶点。
澳门·新葡萄新京6663周天华教授和卓巍教授为该论文的共同通讯作者,澳门·新葡萄新京6663医学院李爽博士,郭东阳博士,孙强博士,张露博士为本论文的共同第一作者。本研究受国家自然科学基金、科学技术部基金、浙江省自然科学基金、中央高校基本科研专项资金的资助。
原文链接:
https://www.nature.com/articles/s12276-023-00946-w












