近年来,基于胚胎干细胞体外构建的“类囊胚”、“类原肠胚”以及“躯干样结构”等胚胎类似模型1-3,帮助人们更加深入的理解脊椎动物形态发生的机制,同时也为研究发育相关疾病提供了补充模型。目前,这些体外模型能够重现和模拟体内重要的发育生物学事件,例如:体轴建立、胚层分化和细胞的定向运动等。然而,目前尚没有较好的方法在体外诱导出脊椎动物较为完整的头部结构,其可能的原因是目前的模型都未能充分模拟原肠运动过程中一些非常重要的发育学事件,例如:胚孔的形成和中内胚层的内卷运动,这些过程对于神经外胚层的正确诱导和图式形成发挥重要的功能。
2023年4月4日,澳门·新葡萄新京6663医学院徐鹏飞团队与哈佛大学医学院Sean G. Megason团队合作,在Cell Reports上发表题为Nodal coordinates the anterior-posterior patterning of germ layers and induces head formation in zebrafish explants的研究论文,报道了利用斑马鱼胚胎干细胞体外构建一个头部类似结构。

徐鹏飞团队之前研究报道在斑马鱼胚胎动物极顶的囊胚细胞或者是斑马鱼胚胎外植体(Explant)中构建Nodal和Bmp两种形态发生素(Morphogen)的浓度梯度能够诱导一个完整的胚胎体轴4,但是这两种形态发生素各自发挥什么功能仍不清楚。在小鼠胚胎干细胞团中构建BMP4的浓度梯度,细胞团会发育成类似于神经发生时期的小鼠胚胎,但缺乏脑部组织,尤其是前脑5。在本研究中,研究人员在斑马鱼外植体中构建Nodal信号的浓度梯度,通过活体成像技术和Imaris定量分析,发现Nodal会诱导外植体产生胚胎原肠运动时期关键的细胞运动,集中延伸运动和内卷运动(图1)。
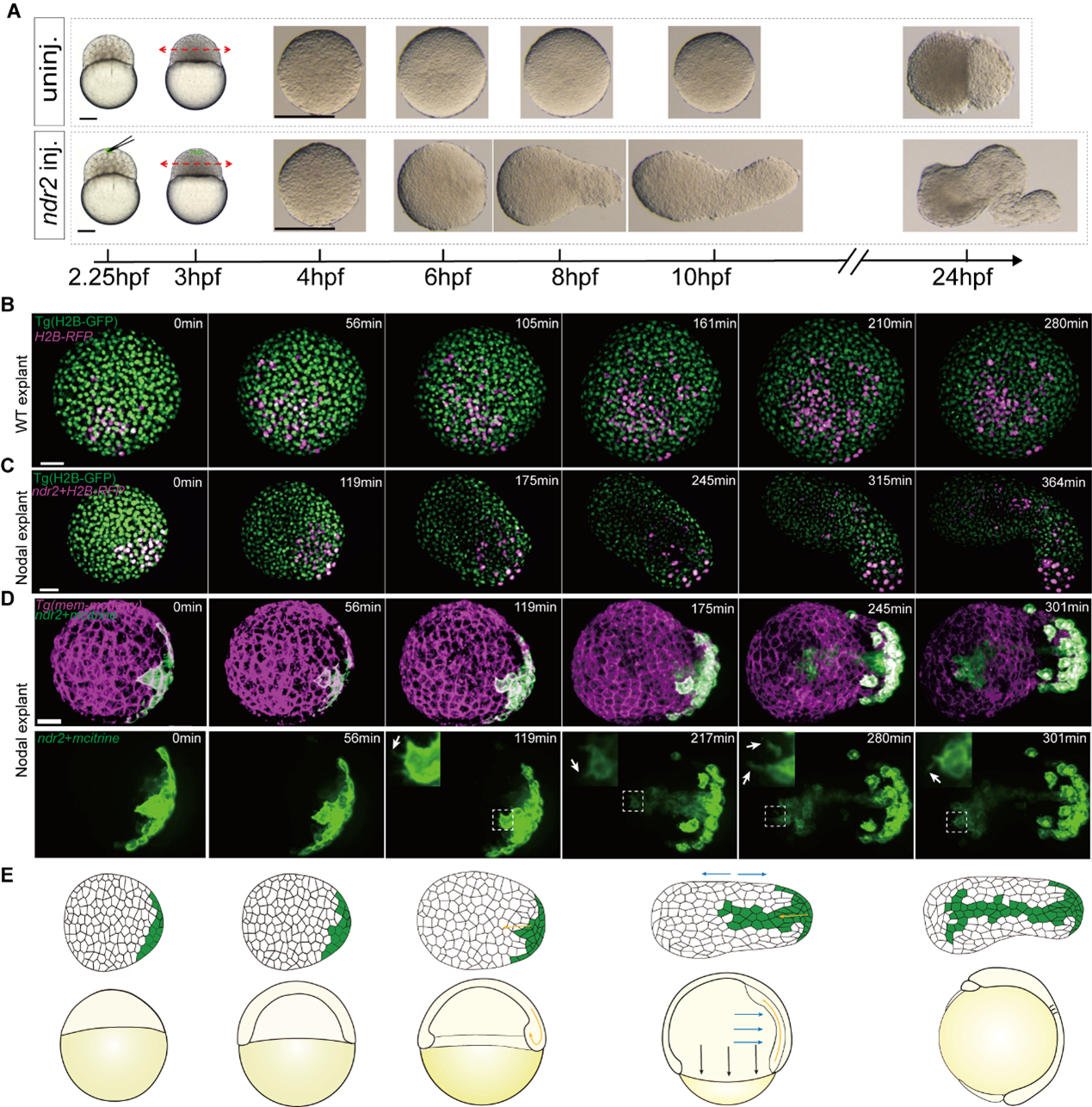
图1 Nodal在斑马鱼外植体中诱导集中延伸运动和内卷运动。
研究人员继续通过单细胞转录组测序和原位杂交技术,构建了从原肠前期到器官生成时期Nodal外植体的细胞分子和空间图示的高分辨动态图谱。通过进一步分析发现:Nodal诱导的中内胚层细胞,包括:前部内胚层、前脊索板、脊索以及类尾牙位于外植体中间沿着前-后轴依次排列。令人惊奇的是位于外植体外围的神经外胚层细胞同样沿着前-后轴依次特化为前脑、中脑、后脑和脊髓。Nodal外植体在原肠运动时期逐步发育成一个头部类似结构(Head Like Structure)(图2)。

图2 Nodal外植体原肠末期(10 hpf)细胞分子和空间图式图谱
通过bulk RNAseq和腹侧过表达实验,研究人员解析了Nodal发挥“组织者”功能的分子基础,他们筛选得到105个Nodal下游靶基因,其中有14个基因具有第二体轴诱导能力,其中5个基因能够诱导完整或部分的头部结构(图3)。
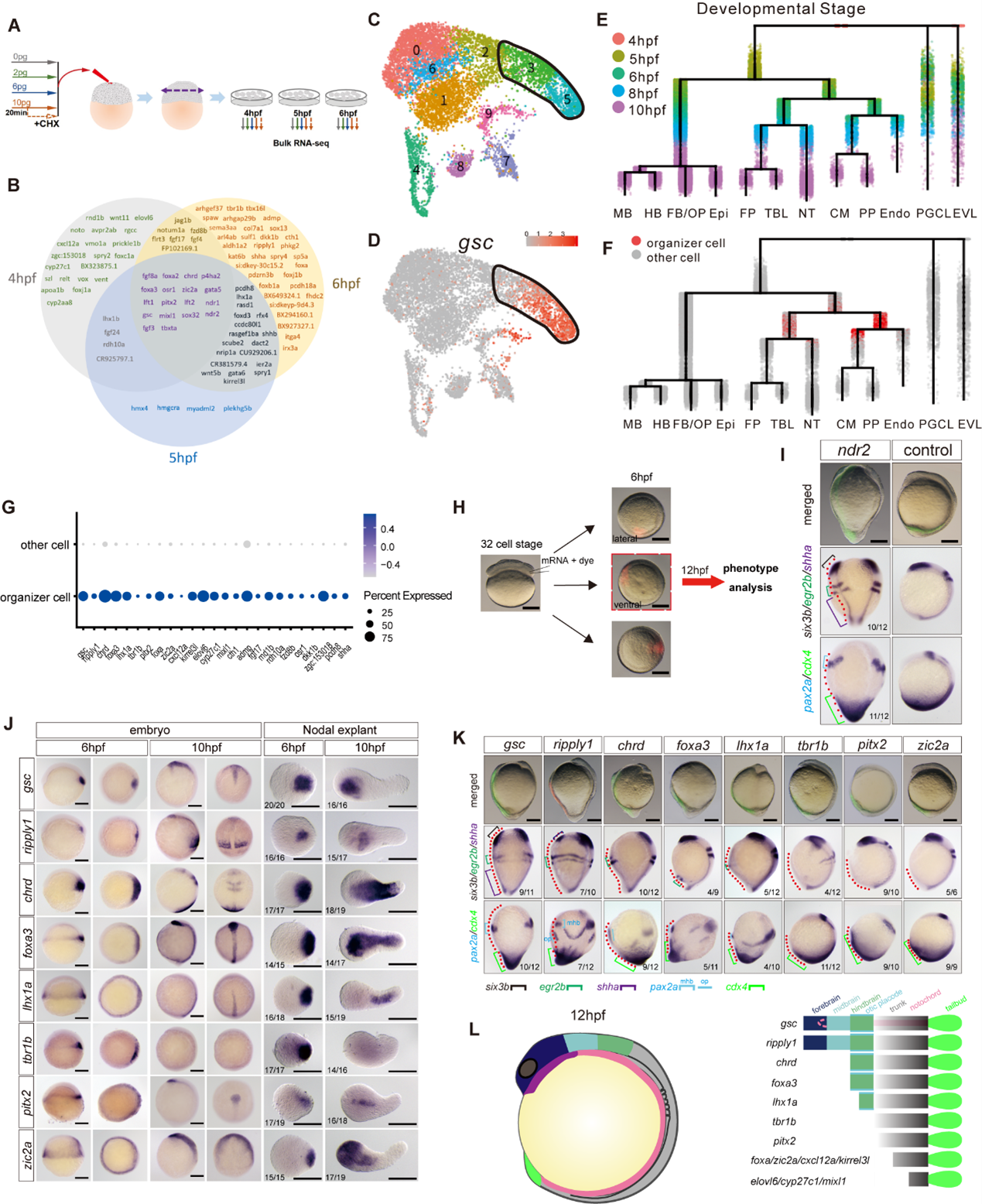
图3 Nodal发挥“组织者”功能的分子基础
此项研究不仅帮助我们进一步理解脊椎动物的头部发育,更重要的是,为体外诱导脊椎动物头部发生提供了可行的策略,这将为更进一步研究脊椎动物头部发育和相关疾病提供了一个优良的模型。同时,这项工作提供了大量的转录组数据和原位杂交数据,为我们进一步解析脊椎动物胚胎发育过程中胚层分化的分子机制、头部图式形成以及Nodal下游的信号通路提供了宝贵的数据资源。这些体外类胚胎技术的成熟与进步将会进一步推进器官移植和再生医学的发展。
澳门·新葡萄新京6663徐鹏飞教授和美国哈佛大学医学院Sean G. Megason教授为本文的共同通讯作者,澳门·新葡萄新京6663医学院程涛博士和邢延奕博士为论文的共同第一作者。该研究受到科技部重点研发计划、国家自然科学基金等项目的资助。该工作致敬著名的发育生物学家Bernard Thisse教授(1959-2021)。研究过程中还受到弗吉尼亚大学Christine Thisse教授,澳门·新葡萄新京6663马骏教授、杨小杭教授和管敏鑫教授的大力支持。
参考文献:
1. Beccari, L., Moris, N., Girgin, M., Turner, D.A., Baillie-Johnson, P., Cossy, A.C., Lutolf, M.P., Duboule, D., and Arias, A.M. (2018). Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids. Nature 562, 272-276. 10.1038/s41586-018-0578-0.
2. Moris, N., Anlas, K., van den Brink, S.C., Alemany, A., Schroder, J., Ghimire, S., Balayo, T., van Oudenaarden, A., and Martinez Arias, A. (2020). An in vitro model of early anteroposterior organization during human development. Nature 582, 410-415. 10.1038/s41586-020-2383-9.
3. Veenvliet, J.V., Bolondi, A., Kretzmer, H., Haut, L., Scholze-Wittler, M., Schifferl, D., Koch, F., Guignard, L., Kumar, A.S., Pustet, M., et al. (2020). Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science (New York, N.Y.) 370. 10.1126/science.aba4937.
4. Xu, P.F., Houssin, N., Ferri-Lagneau, K.F., Thisse, B., and Thisse, C. (2014). Construction of a vertebrate embryo from two opposing morphogen gradients. Science (New York, N.Y.) 344, 87-89. 10.1126/science.1248252.
5. Xu, P.F., Borges, R.M., Fillatre, J., de Oliveira-Melo, M., Cheng, T., Thisse, B., and Thisse, C. (2021). Construction of a mammalian embryo model from stem cells organized by a morphogen signalling centre. Nature communications 12, 3277. 10.1038/s41467-021-23653-4.
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00362-5










