PARP抑制剂利用合成致死(Synthetic Lethality)效应杀死携带BRCA1/2(Breast cancer susceptibility gene)缺陷的肿瘤细胞具有重要的临床意义。然而,一部分肿瘤细胞可以通过恢复同源重组修复或通过重建复制叉稳定性等机制,对PARP抑制剂产生耐药。由于学术界对复制叉稳定性维持机制的研究尚浅,因此,目前对BRCA1/2缺陷肿瘤细胞如何通过重建复制叉稳定性获得PARP抑制剂耐药性的分子机制也知之甚少。
2024年4月22日,澳门·新葡萄新京6663刘婷课题组在《Nature Chemical Biology》杂志在线发表题为“UFL1 triggers replication fork degradation by MRE11 in BRCA1/2-deficient cells”的研究论文。该研究发现,在复制压力下,E3连接酶UFL1催化PTIP蛋白发生UFMylation修饰,进而促进BRCA1/2缺陷细胞中新生DNA链的降解。这一分子机制表明,BRCA1/2缺陷细胞可以通过失活UFMylation通路来重建复制叉稳定性,从而对PARP抑制剂产生耐药。这也是国际上首次报道UFMylation参与复制叉稳定性维持的功能与分子机制。

复制压力发生时,解旋酶与聚合酶发生解偶联或受到核酸酶修剪,导致停滞的复制叉暴露出单链DNA(ssDNA),并与单链结合蛋白RPA复合体结合。随后,重组酶RAD51置换RPA,形成ssDNA-RAD51复合物。接着,在转位酶(Translocase)如SMARCAL1、ZRANB3、HLTF和PICH,以及DNA拓扑异构酶TOP2A和SUMO E3连接酶ZATT等的协作催化下,新生子链DNA经过两步翻转并退火。此时,复制叉形成四叉的霍利迪交叉(Holliday Junction)结构,从而暂时稳定了停滞复制叉。该过程中,RAD51促进复制叉翻转的过程,与解旋酶BLM所推动的复制叉重启相拮抗。刘婷课题组于2024年2月在《Nature Communications》上发表的研究论文报道了TFIP11蛋白结合到停滞复制叉上,通过竞争性抑制BLM与复制叉的结合,促使RAD51与复制叉结合,并促进复制叉翻转的分子生物学机制。此外,为了维持复制的稳定性,停滞复制叉必须防止核酸内切酶SLX4复合物被过度招募其上,切割复制叉并导致复制叉崩塌。刘婷课题组于2024年4月在《The EMBO Journal》上发表的研究论文报道了ssDNA-RPA复合物所招募的ATR激酶如何阻止SLX4核酸酶复合体的过度募集,从而避免复制叉崩塌的分子机制。
BRCA1/2蛋白在复制叉稳定性维持中也发挥关键作用。当翻转发生时,重组酶RAD51与翻转链的结合需要被BRCA1/2稳定,以保护新生DNA链免受MRE11等核酸酶的降解。在BRCA1/2缺陷的肿瘤细胞中,由于复制叉无法维持其稳定性,这些细胞对PARP抑制剂表现出高度敏感,导致合成致死。
UFMylation是一种类泛素化修饰,其修饰遵循与泛素化修饰相似的E1-E2-E3级联反应过程,将类泛素蛋白UFM1(Ubiquitin-fold modifier 1)共价连接到底物蛋白的赖氨酸残基(K)上,其中UFL1(UFMylation E3-like ligase 1)是目前唯一已知的E3连接酶。自2004年发现UFMylation以来,尽管这一翻译后修饰已被证明在调节胚胎发育、内质网稳态和基因组完整性等方面具有重要意义,但迄今为止,已发现的UFMylation底物十分有限,尚未有UFMylation参与复制叉稳定性调控的报道。
刘婷课题组在本研究中发现,在BRCA1/2缺陷的细胞中,当UFMylation的E3连接酶UFL1被敲减时,部分恢复了由PARP抑制剂所引起的基因组不稳定性,并证明该表型的出现并非由于同源重组修复被重建,而是由于在复制压力下,新生DNA链不再受到降解。进一步的研究表明,在BRCA1/2缺陷的细胞内,UFL1催化核酸酶MRE11的关键招募蛋白PTIP发生第148位赖氨酸(K148)的UFMylation修饰。而PTIP蛋白的UFMylation修饰则进一步促进了PTIP- MLL3/4甲基转移酶复合体的组装,进而使得停滞复制叉处组蛋白H3K4的甲基化水平显著增加。核酸酶MRE11随后响应该甲基化信号,被招募到停滞复制叉上,降解新生DNA。
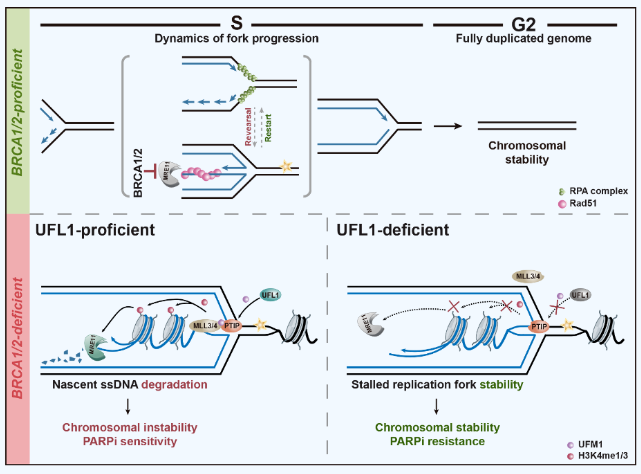
图1 工作模式图
综上所述,本文首次报道了UFMylation参与调节复制叉稳定性的功能与机制,系统阐明了UFMylation促进BRCA1/2缺陷细胞中新生DNA链在复制压力下发生降解的分子生物学过程,并深入揭示了当UFL1缺失时,核酸酶MRE11无法降解新生DNA链,从而重建复制叉稳定性,使细胞对PARP抑制剂产生耐药性的分子机制。
该项工作主要由澳门·新葡萄新京6663刘婷课题组研究助理田甜完成,田甜为该论文的第一作者,澳门·新葡萄新京6663刘婷教授为该论文的通讯作者。本研究得到了国家自然科学基金委、国家科技部重点研发计划等项目资助。
刘婷课题组致力于研究DNA损伤应答与基因组不稳定性的分子机制研究,①应用细胞分子生物学、生物化学、生物信息学、结构生物学等多种实验手段,阐明细胞应答DNA损伤、维持基因组稳定性的分子机制;②应用基础研究与疾病模型相结合的方式深入研究与DNA损伤应答异常相关疾病(如肿瘤等)发生的分子机制;③从DNA损伤应答系统入手探寻对肿瘤等相关疾病进行治疗的最佳靶向方式。研究成果发表于Science、Nat Chem Biol、Nat Commun、Proc Natl Acad Sci U S A、EMBO J、Cell Rep、EMBO Rep.等知名学术刊物,欢迎具有细胞分子生物学等相关背景的学生、博士后、技术员加盟。
课题组详细信息请见网站https://person.zju.edu.cn/tliu










