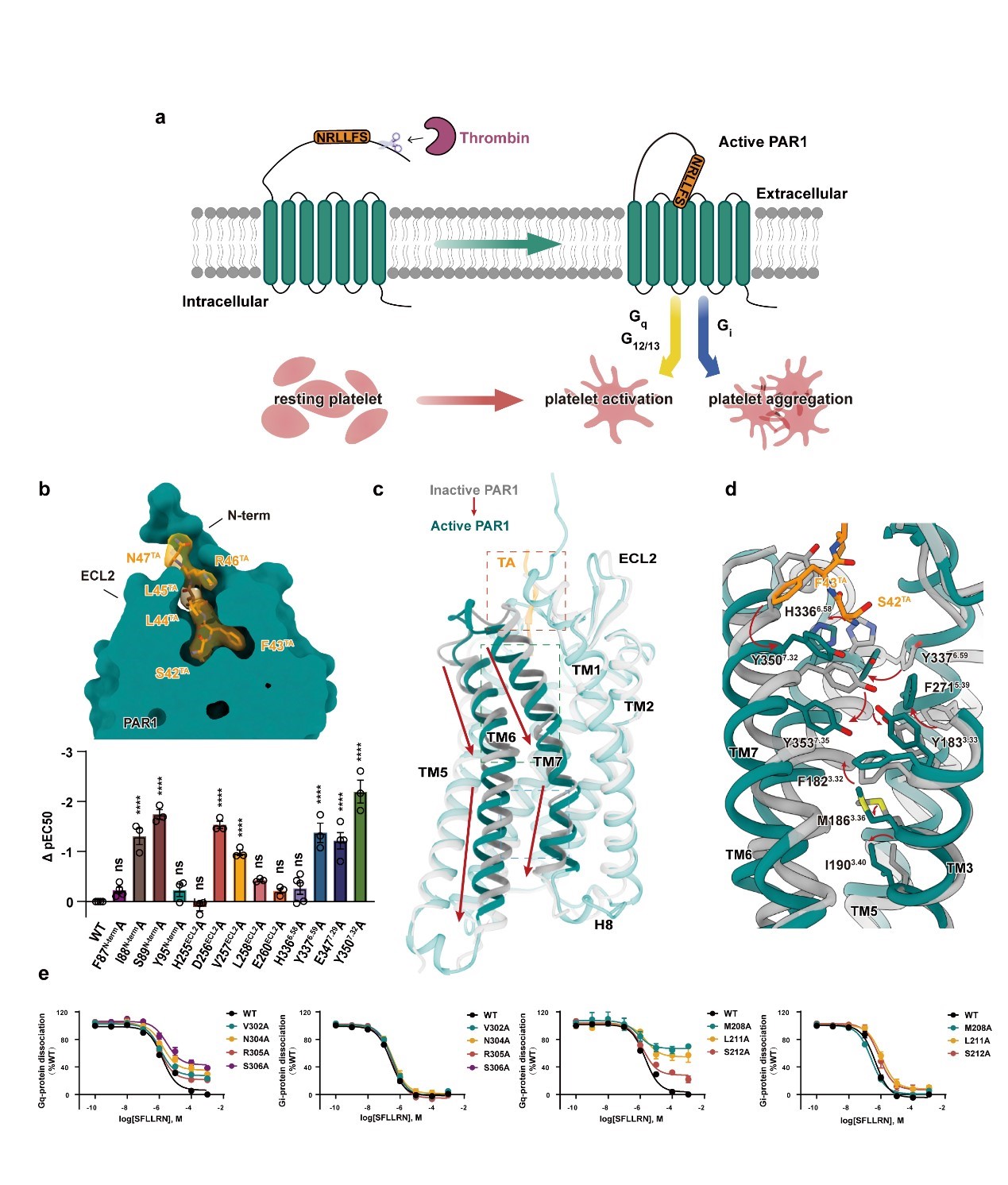
血栓被称为生活中的“隐形杀手”,可在任何年龄、任何时间发生,发病率高且隐匿性强,如果不能得到及时、规范的诊治,将严重危及生命。血栓的形成依赖于血小板的活化和聚集。抑制血小板的活化和聚集是抗栓治疗的主要手段之一,因此与之相关的酶和受体的结构功能研究,以及相关药物开发一直是研究热点。蛋白酶激活受体1(Protease-activated receptors 1,PAR1)是血小板上主要的凝血酶受体,在血小板活化、聚集以及血栓形成中发挥重要作用,是已确证的重要抗栓药物靶标。通常情况下,GPCR的内源性激动剂都是游离的分子,而PAR家族受体采取了一种独特的激活机制:凝血酶识别并特异性切割受体N端,并暴露出一个新的N端,新暴露的N端随后作为栓配体,通过分子内相互作用与受体结合并激活受体(图a)。由于该家族受体仍未有激活态结构报道,其栓配体偶联机制、受体激活机制以及G蛋白结合机制仍然未知,阻碍了靶向该家族受体的药物研究进程。
2024年7月12日,澳门·新葡萄新京6663张岩/毛春友团队联合上海药物研究所徐华强团队,在Cell Research上发表了题为 “Structural Basis of Tethered Agonism and G protein coupling of Protease-Activated Receptor” 的研究论文,报道了人源PAR1独特的栓配体结合激活机制和G蛋白选择性机制,为开发新型靶向PAR1的G蛋白选择性药物提供了结构基础。
本研究利用单颗粒冷冻电镜技术分别解析了栓配体激活的人源PAR1受体与下游Gq蛋白及Gi蛋白复合物的高分辨电镜结构,分辨率分别为3.0埃和3.2埃。结构分析发现,PAR1的栓配体采取了与粘附类受体完全不同的结合模式,PAR1的栓配体仅由六个氨基酸组成,但与受体的N端、ECL2、TM6和TM7等位置形成了广泛的相互作用,并与ECL2形成了额外的β-sheet(图b)。经过序列比对和结构预测,研究团队发现这一配体识别机制在PAR家族中十分保守,提示该家族受体可能具有相同的配体识别机制。
区别于其他的A类GPCR受体,PAR1的激活过程没有明显的TM6下端外扩,而表现为TM6和TM7的整体向下平移(图c)。配体占据一个很浅的胞外口袋,并通过受体上端的一系列具有较大侧链的氨基酸残基,包括H3366.58, Y3376.59, Y3537.35, F2715.39, Y1833.33, F1823.32, M1863.36等将激活信号从胞外传递到胞内(图d)。
开发选择性拮抗某一特定信号通路的药物一直是PAR1药物研发的重点。本研究通过PAR1与Gq和Gi蛋白复合物结构的解析和功能验证,发现PAR1的ICL2和ICL3在Gq的结合中发挥重要作用,而对Gi的结合影响较小(图e)。ICL2和ICL3在PAR1在G蛋白结合过程中表现出的差异,对开发选择性拮抗PAR1的Gq信号的药物提供了新的设计位点和分子基础。
澳门·新葡萄新京6663医学院博士生郭嘉,周云利为论文共同第一作者;澳门·新葡萄新京6663张岩教授,上海药物研究所徐华强研究员,澳门·新葡萄新京6663医学院附属邵逸夫医院毛春友研究员为共同通讯作者;上海药物研究所谢欣研究员和郭世猛博士为文章提供了重要支持;中国科学院上海药物研究所冷冻电镜平台、澳门·新葡萄新京6663冷冻电镜中心为数据收集给予了大力支持;研究工作得到了科技部、国家自然科学基金、浙江省自然科学基金的资助。
张岩/毛春友团队长期招聘博士后、技术员。有意向者请将详细个人简历(包含个人基本信息、学习和工作经历、主要学术成就、承担科研项目情况、发表论文目录、2-3篇代表性论文全文、专利及获奖情况等)及相关附件发送至zhang_yan@zju.edu.cn和maochunyou@zju.edu.cn,邮件标题注明:应聘某某岗位+本人姓名。符合要求的申请人,将通过电话或邮件的方式发出面试邀请。工作地点:澳门·新葡萄新京6663医学院附属邵逸夫医院(庆春院区)或澳门·新葡萄新京6663医学中心(余杭)。










