蛋白质的凝聚/相分离是细胞内组装无膜细胞器来调控重要生命功能的物理基础。细胞的增殖不仅需要复制DNA,还需要生产出相应的复制依赖性组蛋白来合成新染色体。组蛋白基体(Histone Locus Body)是一种位于细胞核内,专门调控复制依赖性组蛋白(Replication-dependent histone)基因转录的无膜细胞器。但是,为什么组蛋白基体只能特异性地在细胞核内形成,而不在细胞质中形成,是困扰相关领域的一个科学问题。
NPAT蛋白是调控组蛋白基体组装的关键分子,其功能失调与乳腺癌、淋巴瘤等癌症具有密切关系。澳门·新葡萄新京6663郑莉灵课题组于2005年揭示小分子量热激蛋白Cpn10能够与NPAT发生互作,来调控组蛋白基体的形成(Zheng et al., 2005. JBC)。在此基础上,课题组于2024年12月02日在《Journal of Cell Biology》杂志在线发表了研究论文:“KPNA3 regulates histone locus body formation by modulating condensation and nuclear import of NPAT”,揭示了NPAT发生凝聚来形成组蛋白基体的作用,以及核运输受体蛋白KPNA3在其中的关键调控机制。我们通过筛选一系列KPNA家族成员,发现唯有KPNA3能够特异性结合NAPT,从而介导NPAT的转运入核。郑莉灵课题组进一步确认了NPAT的凝聚受到KPNA3的抑制,并鉴定了KPNA3序列中调控NPAT凝聚的关键序列。我们利用一系列生化手段,发现KPNA3结合的NPAT的入核信号序列附近,存在着介导NPAT产生凝聚的关键序列。因此,KPNA3在转运NPAT入核的同时,能够通过空间位阻效应来抑制NPAT的凝聚,从而保证组蛋白基体不会在细胞质中发生错误组装。这一工作揭示了入核转运受体蛋白的“一石二鸟”功能,提出“空间位阻模型”(Steric hindrance model)是KPNA3调控NPAT凝聚及组蛋白基体组装的关键策略。
本研究通过解析核蛋白NPAT发生凝聚的机制,解析了核内无膜细胞器组蛋白基体的形成机理,回答了领域里长期存在的一个科学问题。我们提出的“空间位阻模型”,为核内蛋白相分离的调控机理提出了一种理论解释。徐浩新教授于2023年6月组织的“JCB主编线上讨论会”,为本文发表提供了助力。该课题的开展受到公共技术平台的李艳伟、肖桂凤、刘双双、林赵肖楠、宣君丽等老师以及电镜中心韩琴老师的大力支持。主要工作由生化系博士后徐水波完成,浙四医院研究员高修奎博士为共同第一作者,郑莉灵副教授为最后通讯作者,周以?K教授和浙一医院呼吸科鲍彰副主任医师为共同通讯作者。本研究受到基金委创新研究群体、面上项目、重点研发计划、浙江省自然科学基金重点项目和博士后研究基金等项目的资助。
原文链接:https://rupress.org/jcb/article/224/1/e202401036/277130/KPNA3-regulates-histone-locus-body-formation-by
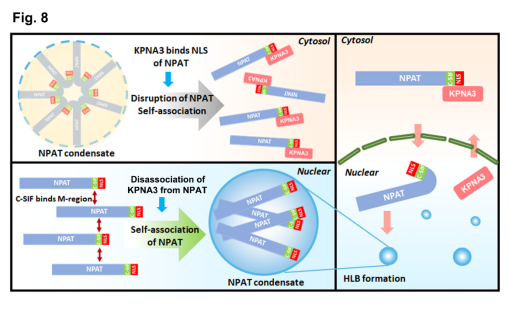
图1:本研究提出的模式图
郑莉灵团队课题组的主要研究方向聚焦于:核内生物大分子相分离(phase separation)在肌肉再生与疾病中的功能与机制。本团队正在招收博士后研究员,简历请发送至: zhengliling@zju.edu.cn或zhouyt@zju.edu.cn;










