肿瘤异质性是癌症的发生、发展以及临床治疗中的关键影响因素。高通量单细胞转录组测序(single cell RNA-seq,scRNA-seq)技术能够精确捕获单个细胞的基因表达信息,为我们深入认识肿瘤内部的异质性和发现稀有细胞类型提供了有力工具。
人工智能在癌症研究和制药创新中发挥着越来越重要的作用。它能够整合庞大的肿瘤数据集,解码肿瘤发生发展背后复杂的生物系统,深化对药物-靶点相互作用的理解,优化治疗策略,并加速新药候选物的识别进程。
然而,目前的抗肿瘤药物筛选主要基于传统的转录组测序数据,往往会忽略肿瘤内部的异质性以及肿瘤细胞与微环境的互作关系。另外,许多研究仅聚焦于单一癌症类型,未能充分利用泛肿瘤数据中蕴含的共性特征。因此,亟需开发基于单细胞泛肿瘤图谱的药物筛选方法,在单细胞水平上实现抗肿瘤药物的高效筛选,并深入揭示药物的作用机制及潜在副作用。

2024年12月10日,澳门·新葡萄新京6663郭国骥/韩晓平/夏宏光等团队合作在National Science Review上在线发表了题为A deep learning framework for in silico screening of anticancer drugs at the single-cell level的研究论文,该项工作推出了一个创新的深度学习框架“神农”(Shennong),为在单细胞水平上开展抗肿瘤药物的计算机辅助筛选提供了新途径。正如上古神农氏尝百草以明药性,今天的“神农”框架也在数字世界中“尝试”药物,预测它们对不同类型肿瘤细胞的作用效果。
泛肿瘤细胞图谱是增进对癌症生物学理解以及改善诊断和治疗的重要资源。研究人员首先使用团队自主研发的高通量单细胞测序技术平台Microwell-seq,构建了一个包含303,351个细胞的泛肿瘤单细胞图谱,涵盖了中国发病率和死亡率最高的肿瘤类型。
通过该肿瘤细胞图谱,研究人员识别出了恶性细胞和癌前细胞(非恶性上皮细胞)。来源于邻近癌旁组织和肿瘤组织的癌前细胞反映了从正常到肿瘤的过渡中间状态。这些癌前细胞表现出与邻近肿瘤相关的分子改变,提示它们在肿瘤发生中发挥重要作用。癌前细胞和恶性细胞之间共享的调控通路和代谢模式强调了区分这些细胞类型的必要性——它们具有异于正常上皮细胞的特征,而这些特征在传统转录组测序中往往难以发现。
通过泛肿瘤分析,研究人员还全面表征了肿瘤相关成纤维细胞和内皮细胞。表达分析和调控模式揭示了肿瘤组织和邻近癌旁组织的基质或内皮细胞之间的相似性,证实了邻近癌旁组织和正常组织细胞的不同功能。泛肿瘤细胞图谱数据集可在交互式网站http://bis.zju.edu.cn/shennong/landscape.html进行访问。
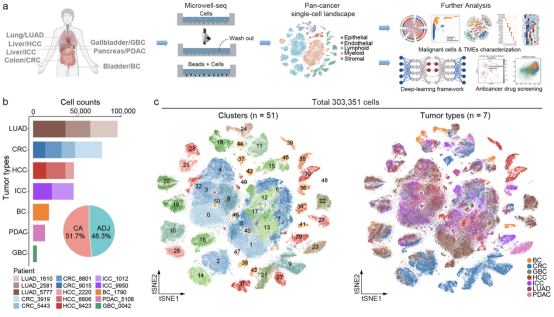
图1 泛肿瘤单细胞图谱的工作流程和细胞数据集统计
传统的药物筛选或药物发现方法通常耗时且成本高昂。人工智能和机器学习方法加速了药物发现和开发的进程。研究人员推出了神农框架,正是这类方法的创新典范。
神农框架以单细胞计数矩阵和预处理的细胞扰动数据为输入。通过基于变分自编码器的深度学习模型,计算每个细胞对特定药物处理的响应强度(潜在得分)和变化趋势(潜在方向)。模型包括含有4个隐藏层的编码器、相同层数但顺序相反的解码器和中间的瓶颈层。考虑到扰动数据的的庞大规模,同时某些细胞可能存在冗余的扰动特征,模型在潜在空间中采用了组套索正则化层,运用类注意力机制为每个细胞富集特征信息丰富的扰动条目。最终输出药物处理对各细胞的影响得分矩阵。
利用贝叶斯检验计算药物处理对不同细胞类型的影响,研究人员获得了富集分数矩阵,以评估不同药物对特定细胞类型的影响。这一方法不仅能预测药物的治疗效果和副作用,指导药物筛选,还能发现针对特定细胞类型的候选药物。通过分析药物处理相关基因在模型解码器中的权重,探究该基因在对应药物处理中的相对重要性,从而识别出特定药物的潜在作用靶点。
10折交叉验证结果表明,神农框架在特征提取和潜在空间的细胞聚类映射方面展现出优异的可重复性。
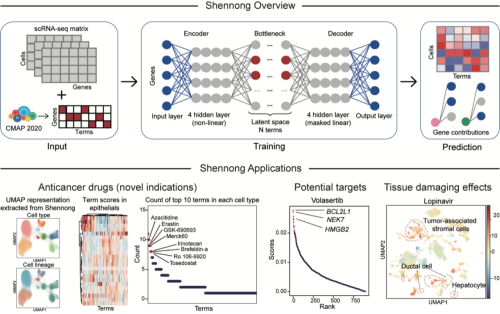
图2 神农框架的搭建流程和应用方向
将神农框架应用于泛肿瘤细胞图谱后,研究人员识别出了一些具有新适应症的FDA批准药物、正在进行临床试验的候选药物以及具有抗肿瘤活性的实验性化合物。例如,FDA批准的乳腺癌治疗药物依西美坦对肺癌细胞表现出显著的抗增殖效果,同时这一发现在一期临床试验中得到证实。候选药物volasertib在多个临床试验中显示出安全性和抗肿瘤活性,能够缓解非小细胞肺癌患者的病情。细胞系实验证实了实验化合物帕苯达唑具有抗肝癌活性,其效果与晚期肝细胞癌的标准疗法(索拉非尼和瑞戈非尼)以及临床试验药物陶扎色替相当。
在药物潜在作用靶点的预测方面,神农框架的分析结果与已知研究高度吻合。例如,对候选药物volasertib的分析显示,其显著影响了多个基因的表达,包括BCL2L1、PLK1、NEK7和HMGB2,这些基因在其对应的解码器中具有极高的权重。
此外,神农框架还能评估药物引起的组织损伤效应,其预测结果与已知的毒性表现和研发停用案例高度一致。例如,框架预测维莫非尼可能损害正常胰腺上皮细胞,这与临床试验中发现的维莫非尼相关胰腺炎病例相符,该不良反应导致欧洲和加拿大更新了药品说明标签。同样,框架预测表面lopinavir可能会对来源于正常组织的肝上皮细胞和基质细胞产生显著影响,这与已报道的lopinavir相关肝损伤病例相吻合。
为了进一步验证神农框架的稳健性,研究人员比较了泛肿瘤细胞图谱和多个第三方数据集的预测结果。训练后的模型成功提取了这些数据集中来自不同组织来源的细胞的独特和共性特征。潜在空间的映射中,相同细胞谱系的细胞簇呈现出明显的聚集趋势。约有30%至45%的化合物与相应第三方数据集中的预测结果重叠。这一比较结果表明神农框架具有良好的稳健性和泛化能力。
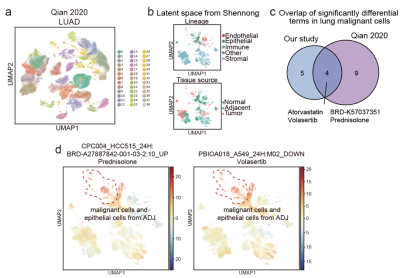
图3 第三方数据集比较
总的来说,本研究推出的深度学习框架“神农”(Shennong)实现了在单细胞水平上准确预测药物反应,不仅可用于筛选潜在抗肿瘤药物并探究其作用靶点,还能评估药物引起的组织损伤效应。神农框架展现出良好的稳健性和可解释性,有望显著提升药物筛选的效率和准确度,加速新药开发进程。
澳门·新葡萄新京6663郭国骥教授、澳门·新葡萄新京6663韩晓平教授、澳门·新葡萄新京6663基础医学/良渚实验室院夏宏光教授和澳门·新葡萄新京6663医学院附属第一医院梁廷波教授为本文通讯作者。澳门·新葡萄新京6663博士后张霈婧、澳门·新葡萄新京6663博士生王雪怡、良渚实验室特聘研究员岑旭峰和澳门·新葡萄新京6663医学院附属第一医院章琦副教授为本文共同第一作者。澳门·新葡萄新京6663/良渚实验室欧阳宏伟教授,良渚实验室王晶晶研究员为本研究提供了重要帮助。研究受到了国家自然科学基金委和浙江省自然科学基金委的支持。
原文链接:https://doi.org/10.1093/nsr/nwae451










