DNA复制是遗传信息传递和生命延续的关键过程。然而,细胞内外的代谢活动及多种损伤因素可能引发复制压力,干扰DNA复制的正常进行,导致基因组不稳定性,并诱发多种疾病。为应对复制压力,细胞演化出多种保护机制以维护基因组的完整性和稳定性。其中,复制叉翻转(fork reversal)是一种在进化中高度保守的策略。在这一过程中,新合成的子链DNA与母链分离并翻转,两条子链相互配对,同时母链重新结合,使复制叉回退,从“三链”结构转变为“四链”结构。通过这一机制,复制叉在复制压力下得以保持动态平衡,避免崩塌,从而在高等真核生物中维持基因组稳定性。
当复制压力解除后,翻转复制叉必须重新启动以完成DNA复制。DNA2作为一种结构特异性核酸酶,在复制叉重启中发挥核心作用。DNA2通过适度切割翻转复制叉上翻转臂的5’DNA末端,生成足够长度的3’DNA突出(3’overhang),为依赖同源重组的复制叉重启提供必要的结构。然而,DNA2活性失控可能导致翻转臂的过度降解,从而引发复制叉崩塌和基因组不稳定。因此,复制压力应答过程中需要精准调控DNA2的活性:一方面细胞需要需避免DNA2对翻转复制叉末端的过早切割以维持其稳定;另一方面又需激活DNA2以有效加工翻转复制叉,保证后续复制叉重启的顺利进行。然而,这一过程中DNA2活性的动态调控机制仍未得到明确解析。
传统观点认为,BRCA1/2蛋白通过招募RAD51形成核纤丝,保护翻转复制叉暴露的末端免受DNA2、MRE11等核酸酶降解。在BRCA1/2缺陷细胞中,由于复制叉保护机制受损,细胞对复制压力的耐受性显著降低。这一缺陷导致BRCA1/2缺陷细胞对PARP抑制剂(PARPi)表现出上千倍的高敏感性,成为PARPi治疗肿瘤的基础。仅依赖BRCA1/2-RAD51的保护是否足以维持翻转复制叉的稳定性?部分PARPi耐药病人并未出现BRCA1/2功能的恢复,或许提示了其它未知保护机制存在的可能性。
2024年12月19日,澳门·新葡萄新京6663刘婷团队在 Molecular Cell 杂志在线发表题为Dynamic Control of RNA-DNA Hybrid Formation Orchestrates DNA2 Activation at Stalled Forks by RNAPII and DDX39A 的研究论文。这项研究首次鉴定出一段RNA-DNA杂交链为翻转复制叉的重要保护因子,揭示了不同于BRCA1/2-RAD51的翻转复制叉末端保护机制。通过揭示 RNAPII-DDX39A 轴对 RNA-DNA 杂交链丰度的动态调控,该研究阐明了 RNA-DNA 杂交链在保护翻转复制叉免受 DNA2 过度降解中的关键作用,以及通过 DDX39A 移除 RNA 链,有序激活 DNA2 以促进复制叉重启,从而维持基因组稳定性的机制。

研究团队在翻转的停滞复制叉上发现了 RNA-DNA 杂交链,并通过 dot blot、PLA、EdU 偶联染色质免疫沉淀及链特异性 DNA 和 RNA 测序(EipNA-seq)等技术,证实该杂交链中的 RNA 是以后滞链为模板,在新生 DNA 的前导链上合成的。进一步研究表明,这一RNA-DNA 杂交链的合成由 RNA 聚合酶 II(RNAPII)介导完成。而解旋酶DDX39A特异性解旋该杂交链,移除RNA,招募DNA2对翻转复制叉末端进行加工,促进复制叉重启。
通过抑制RNAPII或过量表达DDX39A以降低停滞复制叉处杂交链的丰度,研究者观察到复制叉被DNA2切割后过度降解并崩塌,同时伴随大量DNA损伤信号的积累。这一结果表明,RNA-DNA杂交链在复制压力未解除时能够有效抑制DNA2的过早降解,从而避免复制叉崩塌和DNA损伤,确保基因组稳定性。
该研究表明,除了经典的 BRCA1/2-RAD51 介导的保护作用外,RNA-DNA 杂交链也在翻转复制叉末端的保护中发挥了重要作用。研究人员证实,在 DDX39A 缺失的情况下,RNA-DNA 杂交链得以持续存在,从而保护复制叉,部分恢复了 BRCA1/2 缺陷细胞的复制叉稳定性,导致这些细胞对 PARP 抑制剂(PARPi)产生耐药性。通过对 TCGA 数据库的分析,进一步揭示了这一机制与 BRCA1/2 缺陷卵巢癌患者接受铂类药物化疗后不良预后之间的关联。这一发现提示,DDX39A 的表达水平可能成为化疗药物疗效的潜在预测指标。此外,通过采用特异性策略阻断 RNA-DNA 杂交链对翻转复制叉末端的持续保护,有望逆转由此机制引发的 PARPi 耐药问题。
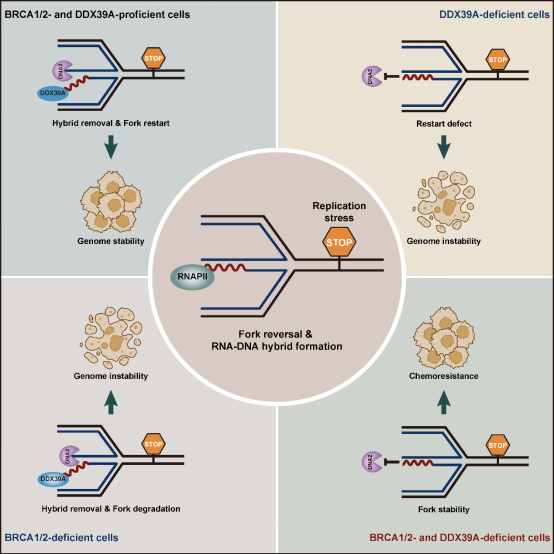
综上所述,这项研究的发现不仅拓展了我们对复制压力应答机制的认识,也为靶向复制叉动态调控以开展肿瘤精准治疗提供了新的思路,尤其是为克服BRCA1/2缺陷癌症中的PARPi耐药性提供了潜在的治疗策略。
澳门·新葡萄新京6663刘婷教授为本文通讯作者,澳门·新葡萄新京6663博士生宋礼志、谢海华、樊浩楠、博士后张燕君、已毕业博士生程子修为本文共同第一作者。该研究工作还得到了澳门·新葡萄新京6663方东教授团队、黄俊教授团队和澳门·新葡萄新京6663医学院附属第二医院周建维教授团队的大力支持。
刘婷课题组长期致力于研究DNA损伤应答与基因组不稳定性的分子机制,通过基础研究与疾病模型相结合的方法,深入探讨与DNA损伤应答相关疾病的分子机制,并探索更有效的靶向治疗策略。研究成果发表于Science、Molecular Cell、Nat Chem Biol、Nat Commun、Proc Natl Acad Sci U S A、EMBO J、Cell Rep、EMBO Rep.等知名学术刊物,诚邀对该领域有兴趣的学生、博士后、技术员等加盟。课题组详细信息请见网站https://person.zju.edu.cn/tliu,申请可发至liuting518@zju.edu.cn。










